氧療是現代醫療最常用手段之一,但人們對氧療適應證理解仍存在誤區,而且氧氣使用不當會帶來嚴重毒性反應。《NEJM循證》曾發表綜述,系統總結缺氧評估、急性與長期氧療的適應證以及氧氣毒性。我們在此簡介該文。
組織缺氧與動脈低氧的評估
組織缺氧的臨床評估
組織缺氧的臨床表現多變且無特異性。缺氧和低氧血症的症狀和體征見圖1。最突出的症狀包括呼吸困難、呼吸急促、心動過速、呼吸窘迫、精神狀態急劇變化和心律失常。
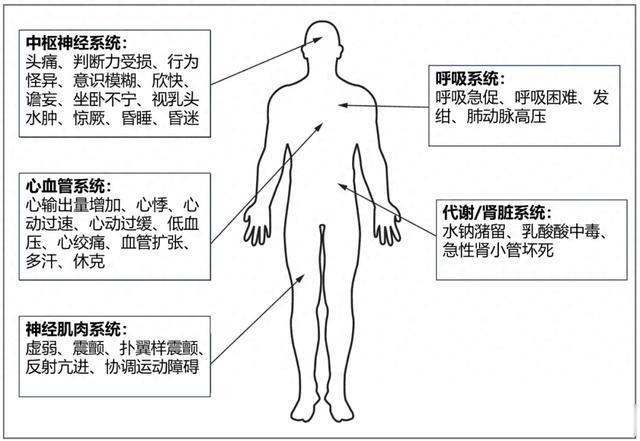
圖1. 各系統急性缺氧的體征和症狀。
爲確定是否存在組織(內髒)缺氧,血清乳酸(缺血和心輸出減少時升高)和 SvO2(心輸出減少時、貧血、動脈低氧血症和高代謝率時降低)有助于臨床評估。然而,乳酸可在非缺氧狀態下升高,因此僅憑乳酸升高並不能確診,因爲在糖酵解增加的狀態下,如惡性腫瘤快速生長、早期膿毒症、中間代謝紊亂和給與兒茶酚胺時,乳酸也會升高。提示特定器官功能障礙的其他化驗值也很重要,如肌酐、肌鈣蛋白或肝酶升高。
動脈氧合狀態的臨床評估
發绀。發绀通常是缺氧晚期出現的症狀,在診斷低氧血症和缺氧時往往並不可靠,因爲貧血和血流灌注不良時可能沒有發绀,而且皮膚較黑的人很難發現發绀。
脈搏血氧飽和度監測。無創脈搏血氧飽和度監測現已廣泛應用于所有疾病的監測,其估計的SaO2被稱爲SpO2。脈搏血氧飽和度監測的原理是比爾定律,即溶液中未知物質的濃度可通過其對光的吸收確定。當光線穿過任何組織時,大部分會被組織的元素和血液吸收。然而,每次心跳時,動脈血會發生搏動性流動,從而使脈搏血氧飽和度監測儀能夠檢測到660納米(紅色)和940納米(紅外)兩種波長光吸收變化。還原血紅蛋白和氧合血紅蛋白在這兩個波長的吸收率不同。在減去非搏動組織的吸收後,可以推算出氧合血紅蛋白相對于總血紅蛋白的濃度。
脈搏血氧飽和度監測存在一些局限性。血液中任何吸收這些波長的物質都會幹擾測量准確性,包括獲得性血紅蛋白病--碳氧血紅蛋白血症和高鐵血紅蛋白血症、亞甲藍以及某些遺傳血紅蛋白變異體。碳氧血紅蛋白在660納米波長處的吸收與氧合血紅蛋白相似;在940納米波長吸收極少。因此,無論一氧化碳飽和血紅蛋白與氧飽和血紅蛋白的相對濃度如何,SpO2都將保持恒定(90% ~95%)。在高鐵血紅蛋白血症中,當血紅素鐵被氧化爲鐵態(ferric state)時,高鐵血紅蛋白會使兩個波長的吸收系數相等。這就導致在一個較爲廣泛的高鐵血紅蛋白濃度範圍內,SpO2僅在83%~87%範圍內變化。在這種情況下,需要使用四種波長的光進行動脈血氧測定,以分辨四種形式的血紅蛋白。
脈搏血氧飽和度監測依賴于充足的搏動性血流;因此,在休克低灌注狀態下或使用非搏動性心室輔助設備時(心髒自身輸出量僅占心排血量的一小部分),脈搏血氧飽和度監測無法使用。在嚴重三尖瓣反流時,靜脈血中去氧血紅蛋白濃度較高,靜脈血的搏動可能會導致血氧飽和度讀數過低。在嚴重動脈低氧血症(SaO2<75%)時,由于該技術從未在這一範圍內進行過驗證,因此准確性也會下降。最後,越來越多的人認識到,脈搏血氧飽和度監測可能會高估動脈血紅蛋白飽和度,高出多達5~10個百分點,具體取決于膚色較深者所使用設備的具體情況。
PaO2/FIO2。PaO2/FIO2 比值(通常稱爲P/F比值,範圍400~500 mm Hg)反映肺髒氧交換異常的程度,由于機械通氣可以准確設定FIO2,因此在該情境下最爲有用。P/F比值小于300 mm Hg表示存在臨床上重要的氣體交換異常,P/F比值小于200 mm Hg表示嚴重低氧血症。影響P/F比值的因素包括通氣設置、呼氣末正壓和FIO2。FIO2的變化對P/F比值的影響不盡一致,這取決于肺損傷性質、分流分數和FIO2的變化範圍。在沒有PaO2時,SpO2/FIO2可以作爲合理的替代指標。
肺泡-動脈氧分壓(A–a PO2)差。A-a PO2差測量的是肺泡氧分壓計算值與動脈氧分壓測量值之間的差值,以此來衡量氣體交換的效率。
在海平面呼吸環境空氣的“正常 ”A-a PO2差隨年齡變化而變化,範圍在10~25 mm Hg(2.5+0.21×年齡[歲])之間。第二個影響因素是FIO2或PAO2。如果這兩個因素中的任何一個增加,A-a PO2差就會增大,這是因爲肺泡毛細血管中的氣體交換發生在血紅蛋白氧解離曲線較平坦的部分(斜率),在靜脈混合程度相同的情況下,混合靜脈血和動脈血之間的PO2差值就會增大。相反,如果肺泡PO2因通氣不足或高海拔而偏低,A-a差就會低于正常水平,可能會導致肺功能障礙被低估或診斷不准確。
氧合指數。氧合指數(OI)可用于機械通氣患者,以評估維持氧合所需的通氣支持強度。它包括平均氣道壓(MAP,單位爲cm H2O)、FIO2和 PaO2(單位爲mm Hg)或SpO2,如果超過40,則可作爲體外膜氧合治療的標准。正常值小于4 cm H2O/mm Hg;由于cm H2O/mm Hg的數值是統一的(1.36),因此通常報告該比值時不含單位。
OI = MAP×FIO2×(100/PaO2)或(采用SpO2代替PaO2)
急性氧療的指征
急性短期補充氧氣的適應證見表1。當患者出現呼吸困難時,通常在低氧血症確診之前就需要補充氧氣。當動脈血氧分壓(PaO2)低于60 mm Hg時,最明確的吸氧指征是動脈低氧血症,這通常對應著動脈血氧飽和度(SaO2)或外周血氧飽和度(SpO2)爲89%~90%。當 PaO2降至60 mm Hg以下時,血氧飽和度可能會急劇下降,導致動脈血氧含量大幅降低,並可能導致組織缺氧。
表1. 氧療的急性指征

除動脈低氧血症外,在少數情況下可能需要補充氧氣。嚴重貧血、外傷和外科重症患者可通過提高動脈血氧含量減少組織缺氧。對于一氧化碳(CO)中毒患者,補充氧氣可增加血液中溶解氧含量,置換與血紅蛋白結合的CO,並提高氧合血紅蛋白的比例。吸入純氧後,碳氧血紅蛋白的半衰期爲70~80 min,而呼吸環境空氣時的半衰期爲320 min。在高壓氧條件下,吸入純氧後,碳氧血紅蛋白的半衰期縮短到10 min以下。高壓氧一般用于碳氧血紅蛋白水平較高(>25%)、心髒缺血或出現感覺異常的情況。
盡管缺乏支持性數據或數據不確切,但其他部分疾病也可能從補充氧氣中獲益。氧療常用于叢集性頭痛、鐮狀細胞痛危象、緩解無低氧血症的呼吸困難、氣胸和縱隔氣腫(促進胸腔空氣吸收)。有證據表明,術中高氧可降低手術部位感染發生率。不過,補充氧氣似乎並不能有效減少術後惡心/嘔吐。
長期氧療指征
隨著門診供氧能力的提高,長期氧療(LTOT)的使用也在不斷增加。實施長期氧療的標准已經非常明確。長期氧療常用于慢性阻塞性肺病(COPD)。表2列出了美國胸科學會(ATS)關于慢性肺病LTOT的指南。
表2. 長期氧療的指征

針對低氧血症型COPD患者的兩項研究爲LTOT提供了支持性數據。第一項研究是1980年進行的夜間氧氣治療試驗(NOTT),在這項研究中,患者被隨機分配到夜間(至少12小時)或持續吸氧。在12個月和24個月時,僅接受夜間供氧患者的死亡率較高。第二項試驗是1981年開展的英國醫學研究委員會家庭試驗,患者隨機分組,不吸氧或每天至少吸氧15小時。與NOTT試驗相似,無氧組的死亡率顯著較高。這兩項試驗的研究對象都是接受最大程度治療且病情穩定的非吸煙患者,這些患者的PaO2低于55 mm Hg,或患有紅細胞增多症或肺心病患者且PaO2低于60 mm Hg。
這兩項試驗表明,每天補充氧氣15小時以上比完全不吸氧要好,持續吸氧比僅夜間治療要好。這些試驗的納入標准是現行醫療保險公司和ATS制定LTOT指南的基礎。推斷其他低氧性心肺疾病接受LTOT也是合理的,但目前還缺乏相關試驗證據。對于COPD患者的低氧血症未達到靜息標准或僅有運動引起的低氧血症,最近的一項多中心試驗發現,氧療對死亡率或生活質量的影響沒有差異。
醫生有時會給睡眠時出現嚴重血氧飽和度降低的患者開夜間補充氧氣處方。目前還沒有明確證據支持在阻塞性睡眠呼吸暫停患者中采用這種做法。對于因阻塞性睡眠呼吸暫停或肥胖低通氣綜合征導致夜間呼吸不暢的患者,無創正壓通氣而非補充氧氣是主要治療方法。
另一個需要考慮的問題是確定空中旅行時是否需要補充氧氣。大多數商用飛機通常會將機艙內壓力加至相當于海拔8000英尺的氣壓,吸入氧張力約爲108 mm Hg。對于肺部疾病患者,吸入氧張力(PiO2)降低會引起低氧血症。旅行前,患者應接受全面醫療評估,包括動脈血氣測試。如果患者在地面時的PaO2≥70 mm Hg(SpO2>95%),那麽他們在飛行中的PaO2很可能會超過50 mm Hg,這通常被認爲足以應付最低限度的體力活動。對于SpO2或PaO2較低患者,可以考慮進行6分鍾步行測試,或進行缺氧模擬測試,通常是呼吸15%氧氣。如果空中旅行出現低氧血症,可以通過鼻導管吸氧以提高氧氣吸入量。
給氧技術
在選擇給氧裝置時,臨床醫生必須考慮低氧血症的程度、患者的分鍾通氣量、裝置所能提供的氧氣流量、裝置的可調性以及裝置的精確度、舒適度和成本。在急診環境中使用的給氧設備可分爲低流量和高流量給氧系統。所需氧氣流量取決于患者的低氧血症程度和分鍾通氣量。分鍾通氣量高或嚴重低氧血症患者需要使用高流量裝置。中度低氧血症患者可能只需要低流量系統,這種系統通常更舒適。
低流量系統
低流量系統提供的純氧僅爲患者分鍾通氣量的一小部分。這些系統的最大氧氣流量爲15 L/分鍾。由于患者的潮氣量和吸氣流速因呼吸快慢而異,因此無法預測每次呼吸的吸入氧量。鼻導管可以2~6 L/分鍾的速度提供舒適的氧氣,同時不影響患者說話和進食。這種流量可在鼻咽部形成一個解剖性的儲氧池,患者在吸氣時可從該儲氧池吸入氧氣。
面罩可以提供比鼻導管更高的流速;它們吸入的環境空氣較少,因此可以産生更高的吸入氧分數(FIO2)。簡易面罩的流速不應低于5 L/分鍾;低于這一水平可能會出現二氧化碳 (CO2) 反呼吸,同時吸氣阻力也會增加。儲氧面罩與簡易面罩類似,但附有一個600~800 ml的儲氣囊。儲氧面罩包括部分再呼吸和非再呼吸類型。使用非再呼吸式儲氧面罩時,氧氣流量應設置得足夠大,以防止儲氧囊癟陷--通常約爲15 L/分鍾。這些面罩提供的最大FIO2爲0.8~0.9,但如果分鍾通氣量和吸氣流速非常高,FIO2可能會更低(0.6~0.8)。
高流量系統
高流量供氧設備通過輸送高流量純氧或氮氧混合物以提供精確恒定的氧氣百分比,其流量需要超過患者的通氣量,有時甚至高達4倍。文丘裏面罩由面罩、噴嘴和夾帶口組成。氧氣在壓力作用下通過噴嘴輸送,噴嘴通過引流口吸入環境空氣。根據夾帶口大小、噴嘴大小和氧氣流速的不同,可以輸送可預測的 FIO2。
近十年中,高流量鼻導管(HFNC)得到發展,其輸送流量遠高于簡單鼻導管,可輸送高達60 L/分鍾的加熱加濕氧氣。HFNC的生理優勢包括消除界面死腔、沖洗鼻咽部的二氧化碳、改善胸腹同步、減少呼吸功以及高達4 cm H2O的呼氣末正壓。系統綜述和荟萃分析表明,在低氧血症型呼吸衰竭患者中,使用HFNC與傳統氧療相比,前者的氣管插管率更低。同樣,如果在高危患者拔管後立即使用HFNC,再次插管率與無創正壓通氣相當,也低于傳統的氧療。
氧中毒
氧中毒的生化基礎
氧毒性由活性氧(ROS)的産生引起。ROS是氧衍生的自由基,帶有一個未配對軌道電子,可與蛋白質、脂類和核酸發生反應,改變它們的結構並造成細胞損傷。在正常線粒體代謝過程中會産生少量ROS,作爲信號分子。免疫細胞也利用ROS殺死病原體。ROS包括超氧化物、過氧化氫(H2O2)和羟自由基。過量ROS無一例外地會超出細胞防禦功能,導致死亡或誘發細胞損傷。
爲了限制由ROS生成介導的損傷,細胞的抗氧化保護機制可以中和自由基。超氧化物歧化酶將超氧化物轉化爲H2O2,後者又被過氧化氫酶和谷胱甘肽過氧化物酶轉化爲H2O和O2。谷胱甘肽是限制ROS損傷的重要分子。其他抗氧化分子包括α-生育酚(維生素E)、抗壞血酸(維生素C)、腦磷脂和半胱氨酸。人體肺部組織含有高濃度的細胞外抗氧化劑和超氧化物歧化酶同工酶,因此與其他組織相比,暴露于更高濃度氧氣中也不易産生毒性。
高氧誘導的ROS介導的肺損傷分爲兩個階段。首先是滲出期,其特點是肺泡1型上皮細胞和內皮細胞死亡、間質水腫,肺泡中填充滲出性中性粒細胞。隨後是增殖期,內皮細胞和2型上皮細胞增殖,覆蓋先前暴露的基底膜。氧損傷恢複期的特點是成纖維細胞增生和間質纖維化,但毛細血管內皮和肺泡上皮仍保持大致正常的外觀。
肺氧中毒的臨床表現
發生毒性的暴露水平尚未明確。當FIO2小于0.5 時,一般不會出現臨床毒性。早期的人體研究發現,暴露于接近100%氧氣會導致感覺異常、惡心和氣管支氣管炎,並降低肺活量、肺彌散量、肺順應性、PaO2和pH值。其他與氧氣毒性相關的問題包括吸收性肺不張、氧氣引起的高碳酸血症、急性呼吸窘迫綜合征(ARDS)和新生兒支氣管肺發育不良(BPD)。
吸收性肺不張。氮氣是一種惰性氣體,與氧氣相比,氮氣擴散到血液中的速度極低,因此起到維持肺泡擴張的作用。當使用100%氧氣時,由于氧氣吸收率超過了新鮮氣體的輸送率,氮氣缺失會導致肺泡通氣-灌注比(V/Q)較低區域的肺泡塌陷。尤其是在手術期間,由于麻醉和麻痹導致肺功能殘氣量降低,促進小氣道和肺泡塌陷,因此會很快出現肺不張。
氧引起的高碳酸血症。嚴重COPD患者在病情加重期間暴露于高濃度氧時,容易出現嚴重的高碳酸血症。這種高碳酸血症的發生機制在于低氧血症驅動呼吸的能力受到抑制。然而,在任何患者中,還有另外兩種機制在不同程度上發揮作用。
COPD患者的低氧血症是低V/Q區域肺泡氧分壓(PAO2)過低的結果。爲了盡量減少這些低V/Q區域對低氧血症的影響,肺循環的兩種反應--缺氧性肺血管收縮(HPV)和高碳酸血症性肺血管收縮--會將血流轉移到通氣良好的區域。當補充氧氣增加PAO2時,HPV會顯著降低,增加這些區域的灌注,從而産生V/Q比值更低的區域,這些肺組織現在富含氧氣,但消除CO2的能力較弱。這些肺組織灌注量增加是以犧牲通氣較好區域爲代價的,這些區域不能像以前那樣排出大量CO2,從而導致高碳酸血症。
另一個原因是Haldane效應減弱,即與含氧血液相比,去氧血液能攜帶更多CO2。當血紅蛋白脫氧時,它會以氨基甲酸酯的形式結合更多質子(H+)和CO2。隨著氧療中去氧血紅蛋白濃度降低,CO2和H+的緩沖能力也隨之降低,從而削弱了靜脈血運輸CO2的能力,導致PaCO2升高。
在爲慢性CO2潴留患者或高危患者補充氧氣時,尤其是在極度低氧血症的情況下,精細調整FIO2以使得SpO2維持在88%~90%範圍內極其重要。多個病例報告稱,不調節O2會導致不良後果;一項針對CODP急性加重患者在送往醫院途中進行的隨機研究無可爭議地證明了這一點。與不限制氧氣的患者相比,隨機分配到補充氧氣以使SpO2維持在88%~92%範圍內的患者死亡率顯著較低(7% vs. 2%)。
ARDS和BPD。人們很早就發現氧毒性與ARDS的病理生理相關。在非人類哺乳動物中,暴露于100%氧氣會導致肺泡彌漫性損傷,最終死亡。然而,嚴重肺部疾病患者氧毒性的確切證據很難與潛在疾病造成的損害區分開來。此外,許多炎症性疾病都會誘發抗氧化防禦功能上調。因此,多數研究都未能顯示氧氣過度暴露與急性肺損傷或ARDS之間存在關聯。
肺透明膜病是一種由表面活性物質缺乏引起的疾病,以肺泡塌陷和炎症爲特征。患有透明膜病的早産新生兒通常需要吸入高濃度氧氣。氧中毒被認爲是BPD發病機制中的一個主要因素,甚至在不需要機械通氣的新生兒中也會發生。新生兒尤其容易受到高氧損傷,因爲他們的細胞抗氧化防禦功能尚未完全發育成熟;早産兒視網膜病變是一種與反複缺氧/高氧應激相關的疾病,這種效應在早産兒視網膜病變中得到證實。
肺氧毒性的增效作用
有數種藥物可增強氧毒性。氧氣會增加博萊黴素産生的ROS,並使博萊黴素水解酶失活。在倉鼠體內,氧分壓過高會加重博萊黴素誘導的肺損傷,病例報告也描述了曾接受過博萊黴素治療患者在圍手術期暴露于高FIO2時出現ARDS。然而,一項前瞻性試驗未能顯示高濃度氧暴露、既往博萊黴素暴露與術後嚴重肺功能障礙之間存在關聯。百草枯是一種商用除草劑,它是氧氣毒性的另一種增效劑。因此,在處理百草枯中毒和博萊黴素暴露的患者時,應盡可能降低FIO2。其他可能加劇氧中毒的藥物包括雙硫侖和硝基呋喃妥因。蛋白質和營養缺乏會導致高氧損傷,這可能是因爲缺乏對谷胱甘肽合成至關重要的含硫醇氨基酸,以及缺乏抗氧化維生素A和E。
其他器官系統的氧毒性
高氧可對肺部以外器官産生毒性反應。一項大型多中心回顧性隊列研究表明,心肺複蘇(CPR)成功後死亡率升高與高氧之間存在關聯,該研究發現,CPR後PaO2大于300 mm Hg的患者與血氧正常或低氧血症患者相比,院內死亡風險比爲1.8(95% CI,1.8~2.2)。死亡率升高的原因是ROS介導的高氧再灌注損傷使心跳停止後的中樞神經系統功能惡化。最近的一項研究也描述了急診科插管後高氧血症患者死亡率增加,這與PaO2升高程度密切相關。
對于腦損傷和卒中患者,爲沒有低氧血症的患者提供氧氣似乎沒有任何益處。一家創傷中心開展的一項研究發現,與血氧正常患者相比,接受高氧(PaO2>200 mm Hg)治療的腦外傷患者死亡率更高,出院時Glasgow昏迷評分更低。另一項對接受高壓氧治療患者的研究顯示,神經系統預後較差。在一項大型多中心試驗中,爲非低氧血症(飽和度大于96%)的急性卒中患者補充氧氣,對死亡率或功能預後沒有任何益處。
在急性心肌梗死(AMI)中,補充氧氣是一種常用療法,但此類患者接受氧療的價值還存在爭議。在治療合並低氧血症的急性心肌梗死患者時,氧氣是必要的,因爲它可以挽救生命。然而,在沒有低氧血症的情況下,傳統補充氧氣的益處尚不明確。20世紀70年代末,一項雙盲隨機試驗納入157名無並發症的急性心肌梗死患者,對吸氧治療(6 L/分鍾)與不吸氧進行了比較。結果發現,氧療患者的窦性心動過速發生率更高,心肌酶升高幅度也更大,但死亡率沒有差異。
在不伴低氧血症的ST段擡高型急性心肌梗死患者中,鼻導管吸氧8 L/分鍾與吸入環境空氣相比沒有益處。在另一項關于吸氧6 L/分鍾與吸入環境空氣的研究中,急性心肌梗死患者的1年死亡率和再住院率沒有差異。在院外心髒驟停患者中,將血氧飽和度控制在98%~100%與90%~94%相比沒有任何益處。高氧對急性心肌梗死的潛在有害影響包括冠狀動脈收縮、微循環血流分布失調、功能性氧氣分流增加、耗氧量減少以及成功再灌注區域ROS損傷增加。
最後,臨床試驗和荟萃分析研究了重症住院患者的合適SpO2目標值。一項針對434名重症監護病房患者的單中心、開放標簽隨機試驗比較了保守氧療(SpO2目標94%~98%)和傳統療法(SpO2值97%~100% )。隨機分配接受保守氧療患者的重症監護病房死亡率有所改善,休克、肝功能衰竭和菌血症發生率較低。隨後的一項荟萃分析納入25項臨床試驗,這些試驗共招募了16,000余名住院患者,他們的診斷各不相同,包括卒中、創傷、敗血症、心肌梗死和急診手術。這項荟萃分析的結果顯示,接受保守吸氧策略患者的住院死亡率增加(相對風險,1.21;95% CI,1.03~1.43)。
然而,隨後進行的兩項大型試驗未能顯示保守吸氧策略對肺部疾病患者無呼吸機天數或ARDS患者28天存活率有任何影響。最近,一項針對2541名接受機械通氣患者的研究發現,在三種不同的SpO2範圍(88%~92%,92%~96%,96%~100%)內,有針對性地補充氧氣不會影響28天內無機械通氣的存活天數、死亡率、心髒驟停、心律失常、心肌梗死、卒中或氣胸等結局。根據這些數據,英國胸科學會指南主張大多數成年住院患者的目標SpO2範圍爲94%~98%。這是合理的,因爲SpO2在此範圍內(考慮到脈搏血氧監測儀有±2%~3%的誤差)對應的PaO2範圍爲65~100 mm Hg,這一血氧水平安全且足夠。對于有高碳酸血症型呼吸衰竭風險的患者,88%~92%是一個更安全的目標,可以避免O2引起的高碳酸血症。
總結
自20世紀上半葉以來,氧療已成功地爲醫療護理帶來了革命性的變化。氧療可以改善氧氣輸送,逆轉組織缺血。補充氧氣在門診慢性、嚴重肺部和心髒疾病患者的治療中發揮著廣泛的作用。在門診中,對于那些願意使用補氧的患者,補氧可以大幅改善他們的生活質量。盡管補充氧氣的適用範圍很廣,使用也相對方便,但氧氣必須被視爲一種有治療窗口期的藥物,超過這個窗口期就有可能産生明顯毒性。
參考文獻
1. Wemple ML, Swenson KE, Swenson ER. Oxygen therapy part 1 - History, physiology, and evaluation. NEJM Evid 2023;2(5):EVIDra2300005.
2. Wemple ML, Swenson KE, Swenson ER. Oxygen therapy part 2 - Indications and toxicity. NEJM Evid 2023l;2(7):EVIDra2300111.
轉自:NEJM醫學前沿
